 O sistema Maestro Rechargeable System, o primeiro dispositivo para tratar a obesidade aprovado pela FDA desde 2007, é aprovado para tratar pacientes com 18 anos ou mais que não tenham sido capazes de perder peso com um programa de perda de peso, e que têm um índice de massa corporal de 35 a 45 kg/m², com pelo menos uma outra condição relacionada à obesidade, tais como diabetes mellitus tipo 2 e hipertensão arterial.
O sistema Maestro Rechargeable System, o primeiro dispositivo para tratar a obesidade aprovado pela FDA desde 2007, é aprovado para tratar pacientes com 18 anos ou mais que não tenham sido capazes de perder peso com um programa de perda de peso, e que têm um índice de massa corporal de 35 a 45 kg/m², com pelo menos uma outra condição relacionada à obesidade, tais como diabetes mellitus tipo 2 e hipertensão arterial.
O índice de massa corporal (IMC), que mede a gordura corporal com base no peso corporal de um indivíduo e a sua altura, é usado para definir as categorias de obesidade. De acordo com Centers for Disease Control and Prevention (CDC), mais de um terço de todos os adultos americanos são obesos e pessoas com obesidade têm um risco aumentado para doença cardíaca, acidente vascular cerebral (AVC), diabetes tipo 2 e certos tipos decâncer.
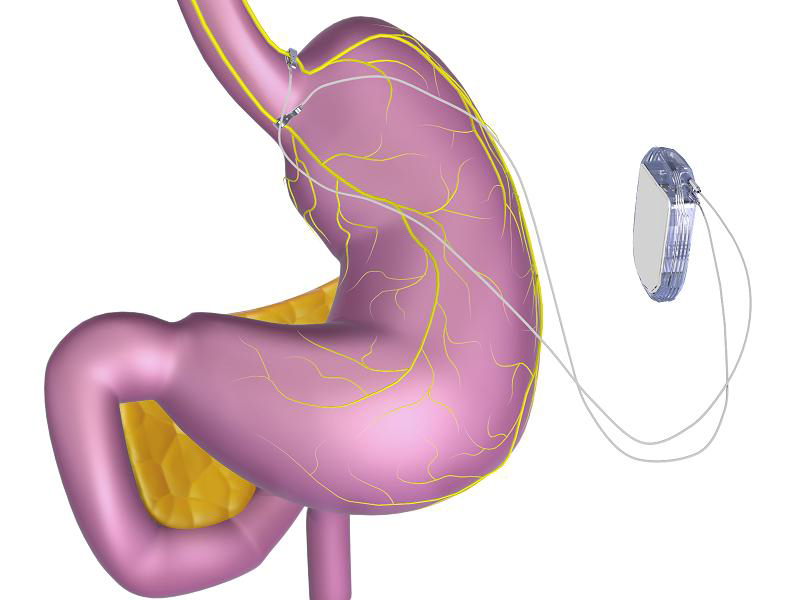 O sistema Maestro Rechargeable System consiste em um gerador de pulso elétrico recarregável, fios condutores e eletrodos implantados cirurgicamente no abdome. Ele funciona através do envio de pulsos elétricos intermitentes para os troncos do nervo vago abdominal, que está envolvido na regulação do esvaziamento doestômago e sinalização para o cérebro de que o estômago se sente vazio ou cheio. Embora seja conhecido que a estimulação da atividade elétrica bloqueia a atividade do nervo entre o cérebro e o estômago, os mecanismos específicos para a perda de peso devido à utilização do novo dispositivo são desconhecidos.
O sistema Maestro Rechargeable System consiste em um gerador de pulso elétrico recarregável, fios condutores e eletrodos implantados cirurgicamente no abdome. Ele funciona através do envio de pulsos elétricos intermitentes para os troncos do nervo vago abdominal, que está envolvido na regulação do esvaziamento doestômago e sinalização para o cérebro de que o estômago se sente vazio ou cheio. Embora seja conhecido que a estimulação da atividade elétrica bloqueia a atividade do nervo entre o cérebro e o estômago, os mecanismos específicos para a perda de peso devido à utilização do novo dispositivo são desconhecidos.
Controladores externos permitem que o paciente possa carregar o dispositivo e que os profissionais de saúdeajustem as configurações do dispositivo, a fim de fornecer a terapia adequada com os mínimos efeitos colaterais.
A segurança e eficácia do Maestro Rechargeable System foram avaliadas em um estudo clínico que incluiu 233 pacientes com IMC de 35 kg/m² ou superior. A perda de peso e os eventos adversos de 157 pacientes que receberam o dispositivo (grupo experimental) foram comparados aos de 76 pacientes no grupo controle que receberam um gerador de impulsos elétricos não ativado. Após 12 meses, o grupo experimental perdeu 8,5% mais do seu excesso de peso do que o grupo controle. Cerca de metade (52,5%) dos pacientes no grupo experimental perdeu, pelo menos, 20% do seu excesso de peso e 38,3% dos pacientes do grupo experimental perdeu, pelo menos, 25% do seu excesso de peso.
O estudo clínico não cumpriu o seu objetivo original, que era do grupo experimental perder pelo menos 10% mais do excesso de peso do que o grupo controle. No entanto, um comitê consultivo da FDA (Gastroenterology and Urology Devices Panel) encontrou nos dados de 18 meses de acompanhamento uma perda de peso sustentada e concordou que os benefícios do dispositivo superam os riscos do uso em pacientes que preencheram os critérios de indicação propostos para o uso do dispositivo.
Ao considerar os benefícios e os riscos do dispositivo em sua revisão do Maestro Rechargeable System, a FDA considerou o estudo clínico e as recomendações do comitê. Além disso, a Agência avaliou uma pesquisa patrocinada pela FDA relativa às preferências dos pacientes por dispositivos de obesidade que mostrou que um grupo de pacientes aceitaria os riscos associados ao dispositivo implantado cirurgicamente para alcançar os valores de perda de peso que deverão ser fornecidos pelo dispositivo.
Como parte da aprovação, o fabricante deve realizar um estudo de cinco anos após a aprovação que seguirá pelo menos 100 pacientes e coletará dados de segurança e eficácia adicionais, incluindo a perda de peso, os eventos adversos, revisões cirúrgicas, retiradas do dispositivo e mudanças nas condições relacionadas àobesidade.
Os eventos adversos mais sérios relatados no estudo clínico foram náuseas, dor no local do neurorregulator,vômitos, bem como complicações cirúrgicas. Outros eventos adversos incluíram dor, azia, problemas dedeglutição, arrotos, náusea leve e dor torácica.
O Maestro Rechargeable System é fabricado pela EnteroMedics de St. Paul, em Minnesota.
Fonte: FDA News Release, de 14 de janeiro de 2015 – News.Med.Br, 2015.
Nenhum comentário:
Postar um comentário